|
Bestimmung der molaren
Masse - Versuch 2
-
Wir messen die Masse eines Feuerzeuges möglichst genau,
idealerweise auf 10 mg oder genauer, und notieren den
Wert als Masse 1.
-
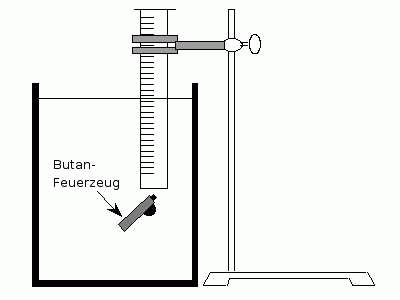
Wir füllen den Messzylinder vollständig mit Wasser aus
dem Aquarium, halten ihn oben zu und tauchen ihn verkehrt
herum in das Aquarium ein. Anschließend fixieren wir den
Zylinder mit einem Stativ.
-
Wir tauchen das Feuerzeug in das Aquarium und lassen von
unten das Butan aus dem Feuerzeug in den Messzylinder
strömen. Dabei ist darauf zu achten, dass alle Gasblasen
auch wirklich in dem Zylinder aufsteigen.
-
Nachdem der Zylinder zu ca. 130–150 ml gefüllt ist,
entfernen wir das Feuerzeug und trocknen es gründlich mit
einem Fön. VORSICHT! Das Feuerzeug darf dabei
nicht zu heiß werden (Gefahr der Explosion). Anschließend
bestimmen wir erneut die Masse des Feuerzeuges und
notieren uns den Wert als Masse 2.
-
Wir lockern den Messzylinder, und senken ihn an der
Stativstange solange auf- bzw. ab, bis das Niveau des
Wassers im Zylinder und außerhalb gleich hoch ist. Dadurch
stellen wir sicher, dass der Druck innerhalb des
Messzylinders der gleiche ist wie der äußere Luftdruck.
Abschließend ermitteln wir folgende Werte:
Raumtemperatur (Raumthermometer), Luftdruck (Barometer),
exaktes Gasvolumen im Messzylinder (wenn nicht bekannt so viel
Wasser einfüllen bis der Zylinder gefüllt ist; das Volumen des
zugegebenen Wassers entspricht dann dem Volumen des Gases im
Zylinder), Massenabnahme des Feuerzeuges (Masse 1 minus Masse
2), Sättigungsdampfdruck des Wassers (mit Hilfe der
ermittelten Raumtemperatur und einer Tabelle).
Wir nehmen an, das Gas im Feuerzeug sei reines Butan (C4H10).
Wir dividieren die Massenabnahme im Feuerzeug durch die
Molmasse
von Butan (58 g/mol). Der resultierende Wert ist die
Stoffmenge Butan in Mol.
|
(Die meisten Einwegfeuerzeuge enthalten jedoch eine Mischung
aus Butan und Propan, so dass die gemessenen Werte stark vom
Literaturwert abweichen dürften)
Um den wirklichen Druck zu berechnen, den das Butan im
Messzylinder ausübt, subtrahieren wir den Sättigungsdampfdruck
von Wasser bei Raumtemperatur vom äußeren Luftdruck.
Wir haben nun experimentell alle Werte ermittelt um die
Gaskonstante wie folgt errechnen zu können:
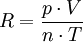
Wenn wir nun in diese umgeformte Form der allgemeinen
Gasgleichung alle ermittelten Werte (die Temperatur in Kelvin,
den Druck in Pascal, das Volumen in Kubikmeter und die
Stoffmenge in Mol) einsetzen, erhalten wir einen experimentell
ermittelten Wert für R.
|